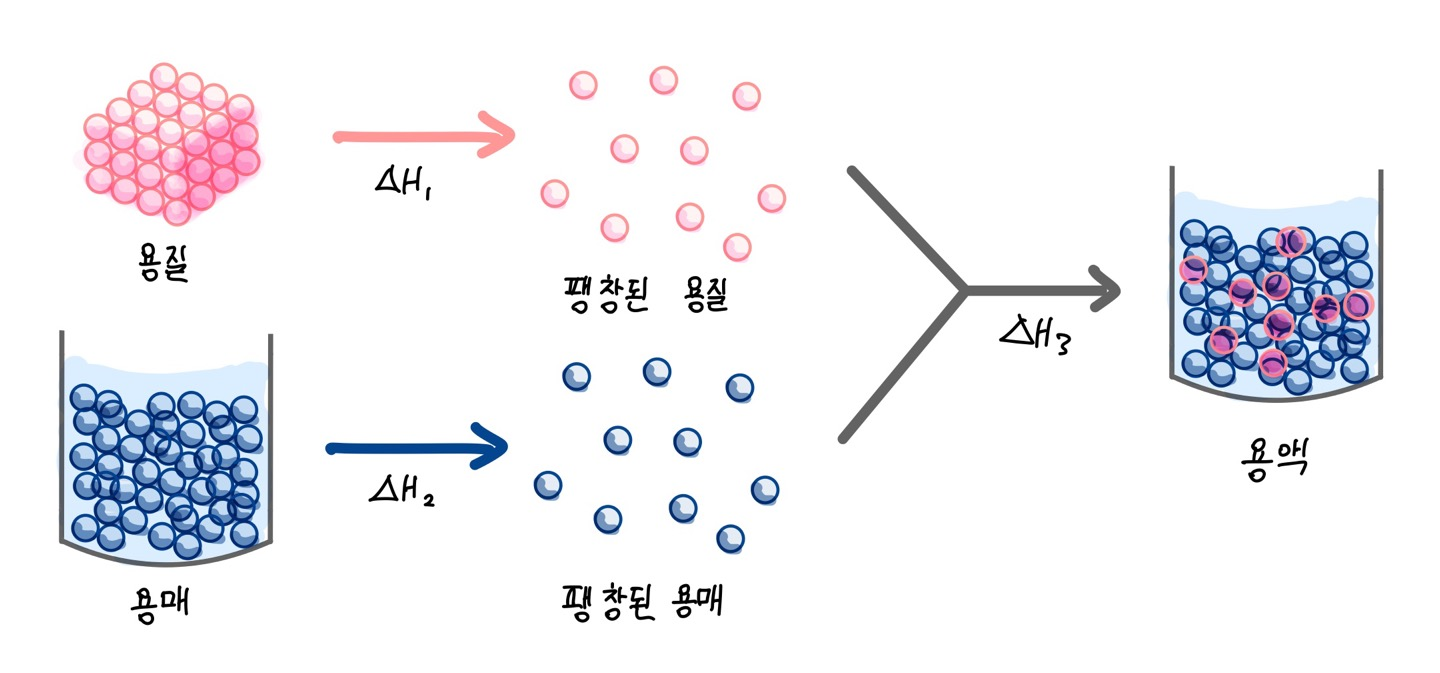
이번 시간에는 용해 평형을 열화학(열역학 아님!!!)적으로 분석해볼 것이다.1. 용해 엔탈피 용해 엔탈피란 물질이 용해될 때의 몰 엔탈피 변화이다. 용해 반응은 용질과 용매 간의 상호작용이기에 엔탈피 변화는 용질-용질, 용매-용매, 용질-용질 간의 인력과 관련이 있다. 따라서 용질-용질의 인력을 끊는 흡열 과정(ΔH1), 용매-용매의 인력을 끊는 흡열 과정(ΔH2), 용매-용질 사이의 새로운 인력을 형성시키는 발열 과정(ΔH3)의 3가지 과정으로 나누어진다. 용질과 용매가 서로간의 인력을 끊는 과정에서 생성되는 물질들을 팽창된 용질, 용매라고 부르고 기체 상태로 이해하는 것이 일반적이다. 따라서 용해 과정을 그림으로 표현해보면 위와 같고 이때 ΔH용해 = ΔH1 + ΔH2 + ΔH3라는 식이 성립하게 된..